癌症疫苗的前景和进展
标签:
自18世纪发明以来,疫苗在预防病毒和细菌引起的疾病方面非常有效,拯救了全球数亿人的生命。疫苗通过模拟感染,刺激人体的自然防御系统来识别和对抗致病微生物。这些疫苗通常含有减毒、灭活或破碎的病原体,在个人接触病毒或细菌之前,预防性接种时最有效。
什么是癌症疫苗?
癌症疫苗是一种利用人体免疫系统对抗癌症的免疫疗法。这些疫苗有两种形式:预防并且治疗。
预防癌症疫苗:
有些病毒被称为致癌病毒,它们可以导致或促成癌症的发展。与流感等导致急性感染的病毒不同,致癌病毒通常会在体内持续存在,导致长期感染。它们可以通过改变细胞基因、抑制免疫功能或诱发慢性炎症来致癌。
预防性癌症疫苗针对这些致癌病毒,降低感染风险并降低患上病毒相关癌症的几率。这些疫苗接种给健康个体,以在癌症发生前进行预防。
已知有几种致癌病毒会导致癌症,包括:
爱泼斯坦-巴尔病毒(EBV):与伯基特淋巴瘤、非霍奇金淋巴瘤、霍奇金淋巴瘤、鼻咽癌有关
乙型肝炎病毒 (HBV):导致肝细胞癌
丙型肝炎病毒 (HCV):与肝细胞癌有关
人类免疫缺陷病毒(HIV):增加卡波西肉瘤、非霍奇金淋巴瘤、宫颈癌的风险
人类疱疹病毒-8 (HHV-8):导致卡波西肉瘤
人乳头瘤病毒(HPV):导致宫颈癌、阴道癌、外阴癌、阴茎癌、肛门癌和口咽癌
人类 T 细胞淋巴细胞病毒-1 (HTLV-1):导致急性T细胞白血病
默克尔细胞多瘤病毒 (MCV): 导致默克尔细胞癌
其中,预防疫苗包括 HBV 并且 人乳头状瘤病毒, 四种疫苗 经美国食品药品管理局(FDA)批准:
Cervarix®:预防HPV 16 型和 18 型,预防肛门癌、宫颈癌、头颈癌、阴茎癌、外阴癌和阴道癌。
加德西®:涵盖HPV类型16、18、6和11,预防HPV相关的癌症和生殖器疣。
Gardasil-9®:预防其他 HPV 类型(16、18、31、33、45、52、58)以及生殖器疣的 6 型和 11 型,有助于预防更广泛的 HPV 相关癌症。
HEPLISAV-B®:预防乙型肝炎感染,降低患肝癌的风险。
治疗性癌症疫苗:
与预防性疫苗不同,治疗性癌症疫苗旨在治疗现有癌症。它们旨在延缓或阻止癌症生长、缩小肿瘤、防止复发以及消除治疗后残留的癌细胞。这些疫苗刺激免疫系统专门针对和攻击癌细胞。
治疗性疫苗通常由癌细胞、细胞碎片或癌症特异性蛋白质制成,帮助身体识别和对抗疾病。在某些情况下,收集患者的免疫细胞,在实验室中暴露于这些物质,然后再注入以增强免疫反应。一些 治疗性癌症疫苗已获得FDA批准并用于治疗不同癌症:
Sipuleucel-T(Provenge®):这种树突状细胞疫苗用于治疗转移性去势抵抗性前列腺癌,需要移除免疫细胞,用 PA2024(前列腺特异性抗原和前列腺酸性磷酸酶的融合)刺激它们,然后再注入它们以增强人体对抗前列腺癌的能力。研究表明,Provenge 可以延长转移性前列腺癌患者的生存期。
卡介苗 (BCG):BCG 是一种通过导管注射的用于治疗早期膀胱癌的减毒分枝杆菌,可刺激免疫细胞攻击膀胱癌。
Talimogene laherparepvec(T-VEC,Imlygic®):T-VEC 用于治疗无法通过手术完全切除的晚期黑色素瘤,是一种由转基因疱疹病毒制成的溶瘤病毒疫苗,可引发针对癌症的免疫反应。
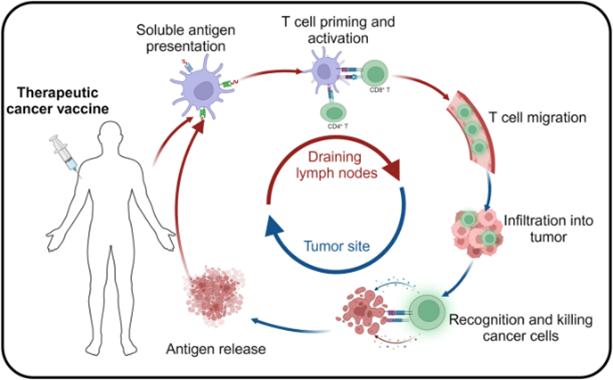
癌症疫苗的体内作用机制
肿瘤抗原被抗原呈递细胞 (APC) 吞噬和处理,抗原呈递细胞通过主要组织相容性复合体 (MHC) 将肿瘤抗原呈递到其表面。这些 MHC 复合体通过与 T 细胞受体 (TCR) 结合激活 T 细胞,从而实现靶向和持续性地破坏肿瘤细胞并抑制肿瘤生长。
癌症疫苗策略的范围
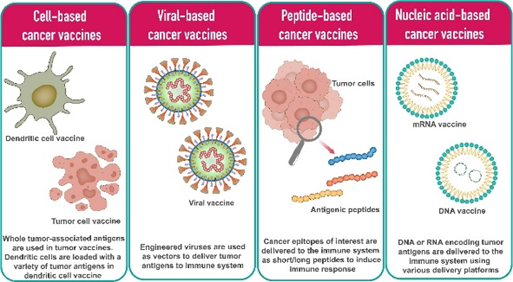
癌症疫苗的开发涉及多种策略来增强对肿瘤抗原的免疫识别。这些方法在传递抗原以触发强烈免疫反应的方式上有所不同。癌症疫苗大致可分为基于细胞、基于肽、基于病毒和基于核酸的平台,每种平台都提供独特的机制来激活免疫系统对抗癌症。
基于细胞的癌症疫苗:
细胞疫苗可以由整个肿瘤细胞(自体或同种异体)或树突状细胞(DC)制成。自体肿瘤疫苗使用患者自身的癌细胞来产生个性化的免疫反应,而无需事先识别特定的肿瘤相关抗原(TAA),但这需要足够的肿瘤样本。另一方面,同种异体疫苗使用标准化的肿瘤细胞系,更容易生产。
树突状细胞是高度特化的抗原呈递细胞 (APC),可激活幼稚 T 细胞。树突状细胞疫苗涉及将肽抗原加载到患者的树突状细胞中或用抗原基因转染。它们已显示出前景,特别是在治疗转移性前列腺癌方面。
基于病毒的癌症疫苗
病毒疫苗利用免疫系统对病毒的天然反应能力,引发强烈而持久的免疫反应。痘病毒、腺病毒和单纯疱疹病毒 (HSV) 等载体通常被使用,而痘病毒因其携带大量转基因插入物的能力而脱颖而出。大多数病毒载体要么是复制缺陷型,要么是减毒型。一个关键挑战是人体免疫系统中和病毒载体,这导致了初免-加强策略的发展,即病毒载体之后使用携带相同抗原的不同载体进行加强。
基于肽的癌症疫苗:
肽类疫苗旨在通过靶向癌细胞中特有或过度表达的 TAA 来触发免疫反应。使用合成肽,可以针对特定癌症进行个性化治疗。这些肽被 APC 吸收,与 HLA 分子一起呈递,并被 T 细胞识别,从而引发有针对性的免疫反应。
基于核酸的癌症疫苗:
核酸疫苗(包括 DNA、RNA)将遗传物质引入 APC 以产生癌症特异性抗原。核酸疫苗已显示出诸多优势,例如能够通过单次免疫递送多种抗原、安全性、特异性地诱导针对目标抗原的免疫反应、诱导体液和细胞免疫反应、生产成本相对较低以及易于制造。然而,DNA 疫苗的细胞摄取效率较低。
RNA 疫苗主要使用信使 RNA,同样旨在诱导 APC 中的抗原翻译。RNA 疫苗被认为比 DNA 疫苗更安全,因为 RNA 降解更快且不会整合到基因组中,从而降低了副作用或自身免疫反应的风险。此外,与 DNA 不同,mRNA 疫苗在细胞质中翻译时不需要到达细胞核。然而,RNA疫苗也面临着有效吸收和抗原产生方面的挑战。
不同类型的癌症疫苗平台
癌症疫苗抗原
由于肿瘤抗原的性质,开发癌症疫苗面临重大挑战。肿瘤抗原可分为两大类:(i) 肿瘤相关抗原 (TAA) 肿瘤和健康组织均有表达;(ii) 肿瘤特异性抗原 (TSA)或 新抗原,其表达仅限于肿瘤病变。
肿瘤相关抗原(TAA)是恶性细胞中过度表达的自身蛋白,分为三类:分化抗原、广泛存在的过度表达抗原和癌症睾丸抗原 (CTA)。然而,由于 TAA 的性质为自身抗原,因此针对 TAA 的癌症疫苗成功率有限。免疫系统对自身抗原的耐受性使得很难在不冒自身免疫风险的情况下引发针对 TAA 的强烈免疫反应。
一个例子是:MUC1是一种糖蛋白,通常在上皮细胞中表达,但在乳腺癌、肺癌和胰腺癌等癌症中过度表达并异常糖基化。虽然基于 MUC1 的疫苗在临床试验中显示出触发免疫反应的前景,但这些反应往往无法产生显著的临床结果,如肿瘤缩小或生存率提高。MUC1 等自身抗原的弱免疫原性和肿瘤逃避机制导致 TAA 疫苗的成功率有限。
为了提高包括 MUC1 在内的 TAA 疫苗的有效性,研究人员正在研究各种策略,例如将疫苗与免疫检查点抑制剂相结合、使用更强的佐剂或开发个性化方法来增强免疫系统瞄准和摧毁肿瘤细胞的能力。
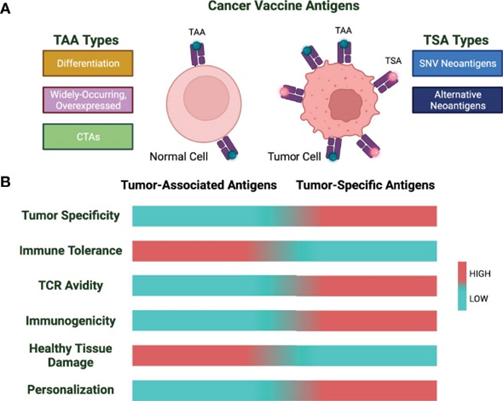
癌症疫苗抗原的类型和特征
肿瘤特异性抗原(TSA)或新抗原是独特的“非自身”蛋白质,由癌细胞突变产生,例如点突变、移码和插入/缺失事件。突变负担较高的肿瘤会产生更多的新抗原,使其成为有价值的治疗靶点。一类关键的 TSA 包括非同义单核苷酸变体 (SNV) 新抗原。
与 TAA 不同,新抗原具有多项优势:它们与 HLA 和 T 细胞受体的结合更强、仅在肿瘤细胞中表达,并避免中枢耐受性和自身免疫问题。然而,只有约 1.2% 的新抗原会引发有意义的抗肿瘤反应,因此精确预测和验证对于疫苗开发至关重要。
新抗原可分为共享新抗原和个性化新抗原。共享新抗原因 TP53 和 KRAS 等常见突变而存在于多名癌症患者中,适合“现成”疫苗。个性化新抗原是每位患者肿瘤所特有的,可根据个体突变谱进行识别。
个性化新抗原癌症疫苗的开发依赖于全基因组和全外显子组测序等先进技术来识别肿瘤特异性突变。生物信息学算法通过分析翻译率、免疫耐受性和 HLA 结合亲和力等因素来预测哪些新抗原可以引发免疫反应,从而发挥关键作用。尽管有许多预测,但只有一小部分新抗原真正具有免疫原性,因此验证至关重要。质谱和 DNA 条形码等工具有助于验证新抗原。疫苗制剂可以包括肽、树突状细胞或 DNA/RNA,具体取决于新抗原的特征。
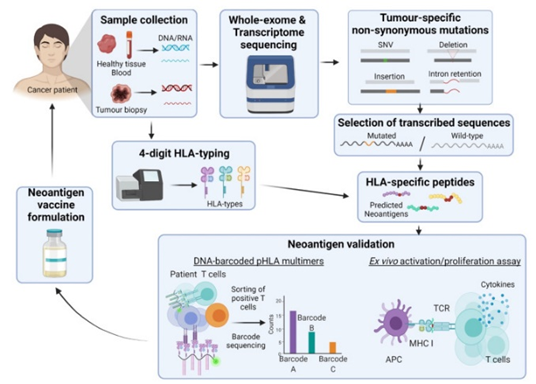
基本新抗原疫苗管道
免疫检查点抑制剂疫苗组合
癌症疫苗与其他免疫疗法 对于提高癌症治疗的效果至关重要。虽然癌症疫苗旨在刺激免疫系统识别和攻击肿瘤细胞,但其功效可能受到各种因素的限制,例如肿瘤逃避免疫检测的能力或免疫激活不足。
将癌症疫苗与免疫检查点抑制剂 (ICI) 相结合是一种有希望提高治疗效果的方法。治疗性癌症疫苗旨在增强肿瘤特异性 T 淋巴细胞,而 ICI 可进一步激活这些细胞。虽然 ICI 单独使用已在 NSCLC 和黑色素瘤等癌症中取得成功,但它们在前列腺癌和胰腺癌等免疫原性较低的肿瘤中的有效性有限。癌症疫苗有助于激活和定位肿瘤特异性 T 细胞至肿瘤微环境 (TME),并通过肿瘤细胞死亡诱导抗原扩散。该过程可以上调免疫检查点分子,使联合治疗更具优势。
ICI 的作用原理是克服通常会限制 T 细胞功能的免疫抑制性 TME。例如,CTLA-4 抑制剂可以通过抵消抑制信号并将 TME 从抑制性转变为允许性来增强疫苗诱导的 T 细胞反应。同样,PD-1 抑制剂可以防止疫苗激活的 T 细胞衰老,从而维持长期的抗肿瘤反应。总体而言,将疫苗与 ICI 相结合不仅可以增强初始免疫反应,还可以通过解决 TME 的抑制性质来帮助维持和增强免疫反应。


