诱导多能干细胞(iPSC)在疾病中的应用
标签:
自十八年前诱导多能干细胞(Induced Pluripotent Stem Cells, iPSC)(也称iPS细胞或iPSC)技术出现以来,干细胞生物学和再生医学取得了巨大进展。iPSC源自上皮细胞或血细胞,这些细胞已被脱分化为胚胎样多能状态,从而能够开发提供目前所需的任何类型人类细胞。例如,iPSC可以被诱导成为β胰岛细胞来治疗糖尿病,血细胞可以为白血病患者产生不含癌细胞的血液细胞成分,或者诱导成为神经元细胞用于治疗神经系统疾病,甚至能诱导称为精原细胞和卵原细胞用于治疗无精无卵子症。
2006,日本东京大学Dr.Shinya Yamanaka 和威斯康辛大学 Dr. James Thompson of the University of Wisconsin同时发表了以小鼠体细胞诱导脱分化多能干细胞的研究。
2007年底,教授团队 Dr. Kathrin Plath、Dr. William Lowry、Dr. Amander Clark 和 Dr.April Pyle 是世界上最早创建人类 iPSC 的人。此前,科学家已经知道组织特异性细胞,如皮肤细胞或血细胞在正常情况下,只能产生其他类似细胞。但是诱导多能干细胞技术这一突破性发现,使iPSC 研究迅速成为新型再生医学的基础。这些科研人员使用 iPSC 技术将皮肤细胞重新脱分化为活跃的运动神经元、卵子和精子前体细胞、肝细胞、骨骼前体细胞和血细胞。此外,患有 ALS、Rett 综合症、Lesch-Nyhan 病和 Duchenne 肌营养不良症等无法治愈的疾病的患者向 BSCRC 科学家捐赠皮肤细胞用于 iPSC 重编程研究。患者及其家属对这项研究的慷慨参与使 BSCRC 科学家能够在实验室研究这些疾病,以期开发新的治疗技术。
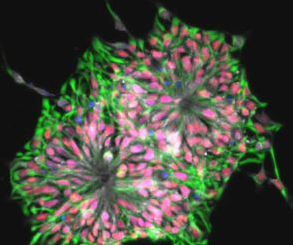
Induced Pluripotent Stem Cells (iPS)
能产生身体所有细胞类型的能力使胚胎干细胞 (ESC) 成为人们关注的焦点,成为再生医学的灵丹妙药。Plath实验室率先将小鼠和人类的分化细胞脱分化为类似 ESC 的状态,即诱导多能干细胞 (iPSC),方法是简单地过表达四种转录因子,遵循山中伸弥 (Shinya Yamanaka) 2006年首次提出的策略。随着人类 iPSC 的产生,通过脱分化使从任何人身上产生多能干细胞变得可行,这开创了个性化医疗和“盘中疾病”建模的时代。
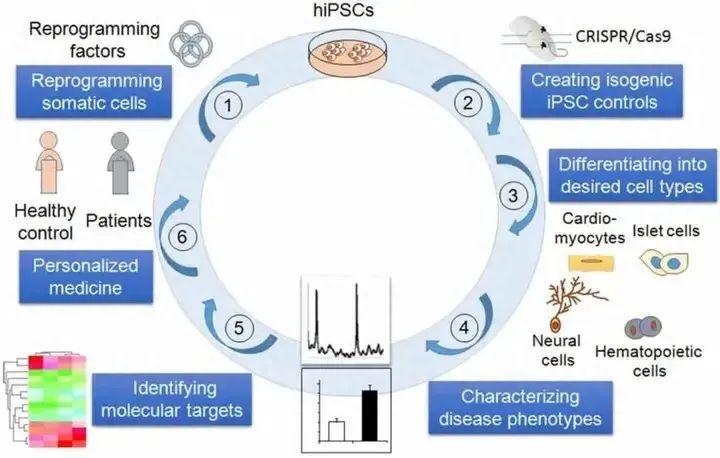
基于人类iPSC的疾病建模示意图
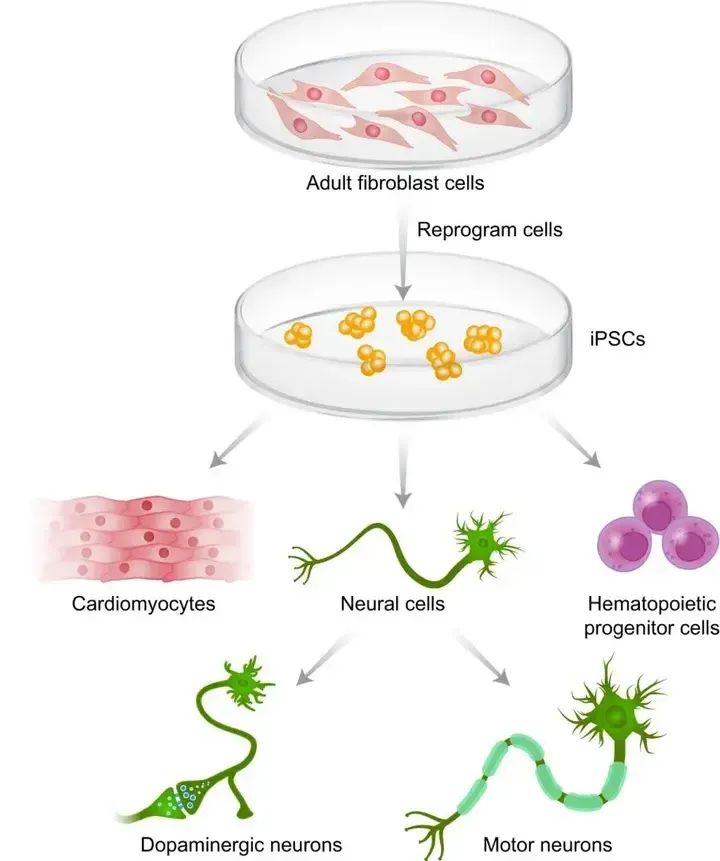
iPSC的产生和分化
在此之前,由于干细胞免疫排斥以及社会伦理问题导致人类干细胞的开发之路并不顺畅。当iPSC诞生时,科学界为之振奋。与其他来源的干细胞不同,iPSC是通过逆转录病毒载体将4个转录因子导入成熟体细胞中,之后重新编码,从而获得具有多分化潜能的干细胞,完美规避了免疫排斥和伦理问题。iPSC的优点主要体现在三个方面:一是iPSC与人胚干细胞的特征高度相似(并不完全等同,在性能上有略微差异),可以在体外无限复制,适用于大规模培养;二是iPSC可根据需求诱导分化成需要的细胞株,且批次间特性相对稳定,可避免临床疗效不一致情况的发生;三是iPSC细胞的来源是成体细胞,既避免了伦理问题,又易于获取。如果iPSC来源于患者自身,还可减小免疫排斥问题。但目前iPSC技术仍存在分化效率较低、致瘤安全风险待验证、异体诱导仍具有免疫原性等问题。
iPSC在疾病中的应用
美国临床实验数据库clinicaltrials检索发现,共有86项iPSC临床试验,2015年,iPSC相关临床试验数量有显著提升,2018年达到峰值并有所回落。其中,最快的已进入Ⅲ期临床(Cynata Therapeutics),但大部分仍处于Ⅰ期临床及临床前阶段。下面就一起了解iPSC在各类疾病中的研究进展吧!
iPSC与肿瘤
嵌合抗原受体(CAR)-T细胞疗法已成为恶性肿瘤治疗中最有前途的治疗策略之一,迄今为止,已有六款CAR-T细胞产品获得美国食品药品监督管理局(FDA)批准用于治疗B细胞白血病/淋巴瘤和多发性骨髓瘤。然而,接受CAR-T细胞治疗的患者必须面对一些风险,包括细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)以及移植物抗宿主病(GVHD)。
介于iPSC具有无限的增殖能力,同时保持其多能性和谱系分化潜力,因此,可产生具有不同纯合人类白细胞抗原(HLA)组合的iPSC系库,根据宿主和移植物之间的HLA匹配选择最佳的iPSC来源,可降低源自自身CAR-T细胞的免疫排斥风险。另一种选择是使用基因编辑来消除HLA-I和/或HLA-II表达。使用iPSC的一个优点是,CAR-T细胞可以从具有克隆扩增能力的单个iPSC克隆中产生,因此它们所经历的遗传修饰在最终细胞群中将是同质的。
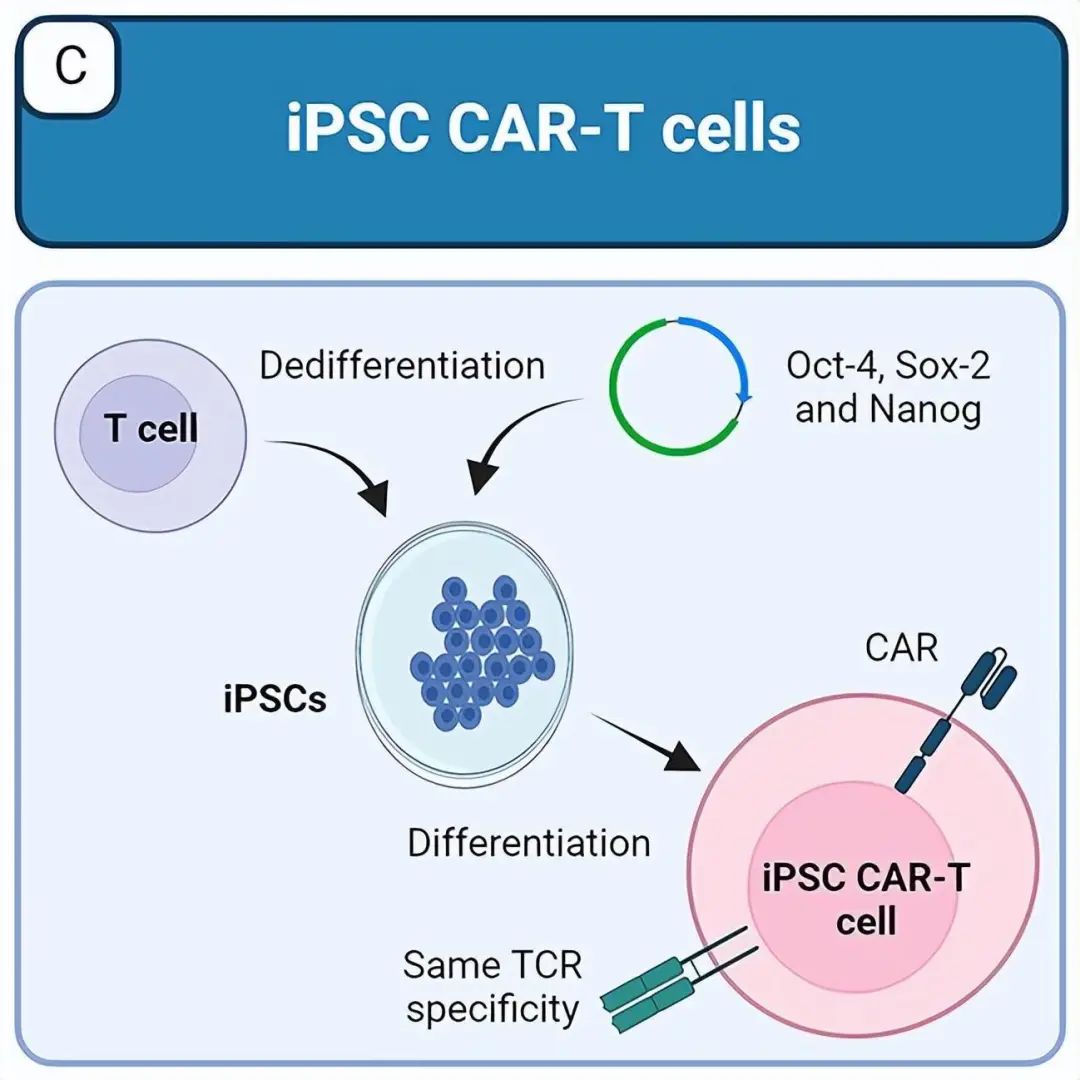
iPSC生产抗肿瘤同种异体CAR-T细胞策略
为了解决免疫排斥问题,Wang等人研发了iPSC衍生的CAR-T细胞,其不仅缺乏HLA-I和HLA-II,还缺乏脊髓灰质炎病毒受体CD155,编码NK细胞激活受体DNAM-1配体,诱导HLA-E的表达,从而防止了NKG2A+NK细胞的排斥。
iPSC与免疫性疾病
利用免疫相关疾病患者来源的iPSC进行基础研究预计将成为阐明免疫性疾病发病机制和药物发现的有前景的平台。由于自身炎症性疾病通常是单基因的,基因突变会影响细胞功能,患者来源的iPSC往往表现出疾病特异性表型。特别是,iPSC衍生的单核细胞和巨噬细胞可用于功能实验。借助iPSC技术,研究人员可以轻松获取人体细胞并使用人体样本研究疾病,并且使用iPSC研究人类免疫相关疾病与传统研究方法相比具有明显的优势,尤其是自身免疫性疾病(图4)。
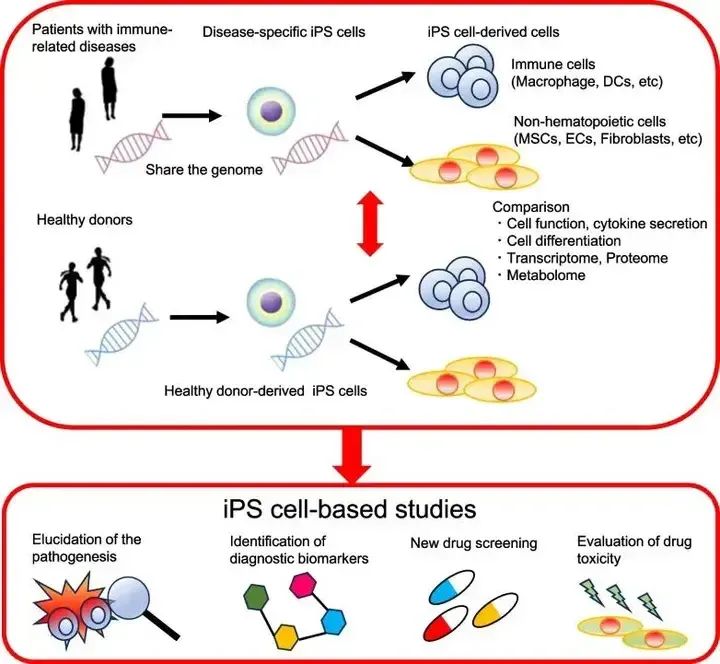
使用患者来源的iPSC研究免疫相关疾病的示意图
为了研究自身免疫性疾病的发病机制,利用iPSC来源的细胞建立体外疾病模型至关重要。由iPSC分化而来的单核细胞和巨噬细胞经常被用来分析免疫相关疾病的表型。免疫相关疾病是由免疫系统失调引起的,其中,自身炎症性疾病的特点是发病机制中促炎细胞因子发挥关键作用,免疫相关基因的突变直接导致疾病,如:周期性发烧综合症、干扰素病以及其他新发现的单基因自身炎症性疾病。而自身免疫性疾病却恰好与自身炎症性疾病相反,由抗原特异性免疫反应失调而引起,如:自身免疫性甲状腺炎、系统性红斑狼疮(SLE)、类风湿关节炎(RA)、强直性脊柱炎(AS)、白塞氏病(BD)、干燥综合征(SS)、系统性硬化症(SSc)等。
自身炎症性疾病通常是单基因的,因此患者来源的iPSC可以表现出与疾病相关的表型,即自身炎症性疾病患者来源的iPSC可用于生物标志物发现和药物筛选。而自身免疫性疾病是多基因的,多种低影响因果变异的积累促进了自身免疫和致病过程,就自身免疫性疾病患者来源的iPSC而言,个体风险基因的影响往往是微妙的,识别致病基因成为一项挑战,特别是因为健康供体来源的iPSC和自身免疫性疾病患者来源的iPSC之间存在差异。虽然环境因素诱发疾病的机制非常复杂且难以在体外复制,但可以使用基于iPSC的研究来评估其影响。尽管基于患者iPSC对自身免疫性疾病的研究存在局限性,但许多采用创新策略的引人注目的研究已经发表。
iPSC与线粒体疾病
线粒体疾病是一组影响任何年龄、任何器官的遗传性疾病,由细胞核和线粒体基因(如线粒体DNA(mtDNA))突变引起,通常是多系统疾病,影响能量需求高的组织或器官(如:神经系统、心脏和骨骼肌),也表现为单一器官和组织(如:耳朵和眼睛)。目前,已经建立了许多针对线粒体疾病的患者来源的iPSC模型(图5)。
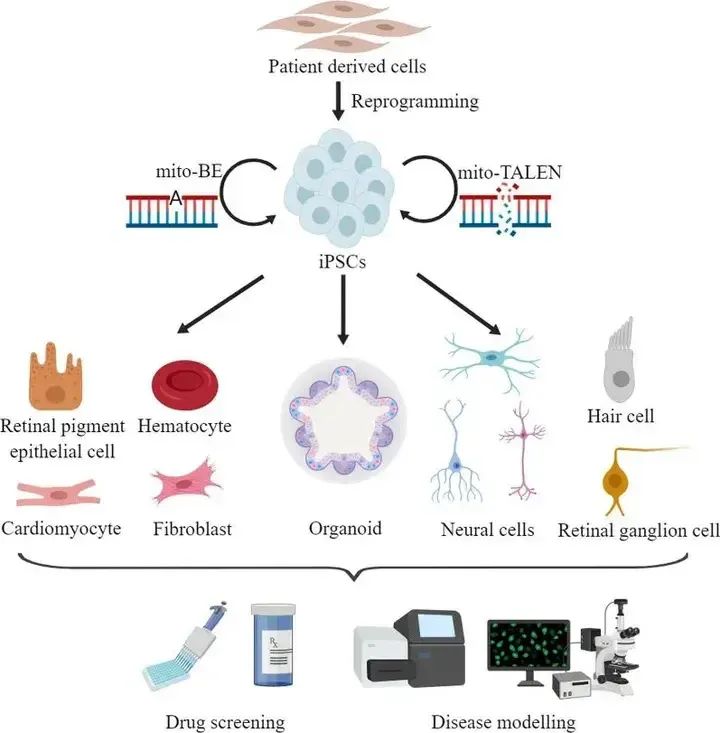
患者源iPSC模型的建立
有学者指出,针对iPSC中的mtDNA进行碱基编辑,可能能够生成线粒体疾病模型并开发潜在的治疗干预措施。但事实上,依赖sgRNA的传统CRISPR/Cas系统与线粒体不相容,2020年,Liu等人设计了无活性split-DddA,可催化人mtDNA中的C•G到T•A的转化。2022年,Kim等人利用TALE改造了源自细菌TadA蛋白的脱氧腺苷脱氨酶,以催化A到G的转化,扩展了mtDNA碱基编辑的应用范围。iPSC技术与基因编辑技术的结合将为生成疾病模型和开发这些疾病的有效治疗方法提供强大的工具(图6)。
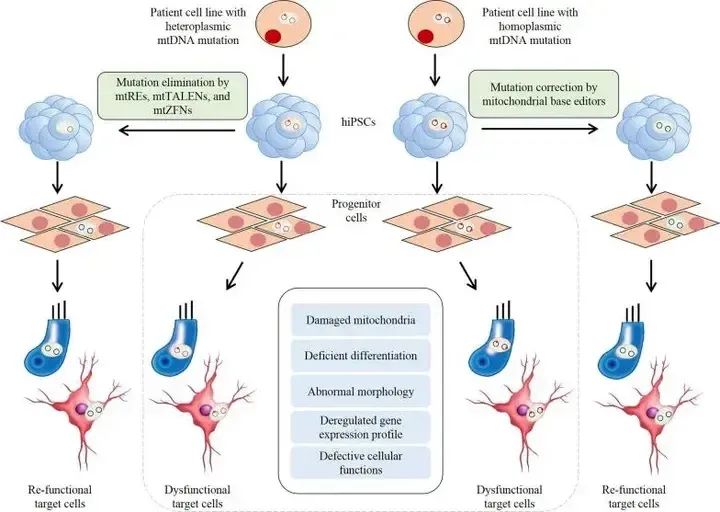
将iPSC与mtDNA基因编辑技术相结合的治疗方法
iPSC与心肌梗死
冠状动脉的急性、持续性缺血缺氧可使该区域心肌细胞血流受限和广泛死亡,从而引起急性心肌梗死。由于人心肌细胞的再生能力有限,梗死的心肌组织最终被纤维化的瘢痕组织所取代,发生病理性重塑,导致心脏收缩能力较差,从而发展为心力衰竭。目前,传统的治疗方法包括溶栓、经皮冠脉介入、冠脉旁路移植术和抗血栓治疗等,但这些方法通常只能控制症状,延缓心脏病理性重塑的进程,而不能挽救心肌的不可逆损伤,长期预后效果不佳。对于终末期缺血性心肌病,心脏移植是唯一治疗方法,但供体资源稀缺,难以满足临床需求。此外,心脏移植术后并发症严重影响患者的生活质量。
研究发现,注射iPSC-CM能改善大鼠、猪、猴等心肌梗死动物模型的心脏功能。将iPSC-CM直接注射到梗死心肌、经静脉或冠状动脉注射到患者体内的方法也已普遍应用。
Guan等在急性心肌梗死大鼠心肌内注射iPSC-CM,4周后心肌细胞在大鼠心脏中存活,并恢复了心肌功能。
Kawamura等将iPSC-CM片移植到急性心肌梗死猪中,证明iPSC分化的高纯度心肌细胞片可以促进由旁分泌作用引起的新生血管生成、抑制纤维化以及减弱心室重塑,从而改善心脏功能。
Ishida等发现移植hiPSC-CM可改善免疫抑制急性心肌梗死猪的心肌功能,且其改善梗死区域心肌收缩功能的效率优于其他体细胞来源的心肌细胞,在严重受损的心肌中临床效益更优。
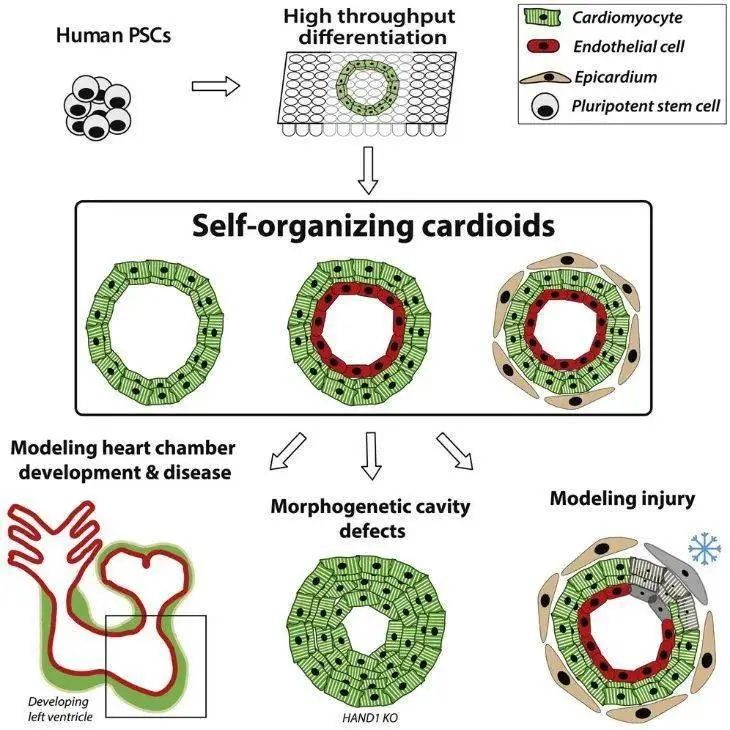
诱导多能干细胞衍生的心肌细胞的移植
基于诱导多能干细胞(iPSC)治疗急性心肌梗死的临床前研究进展
iPSC与心脏病
日本信州大学和庆应义塾大学医学院联合研究团队测试了一种再生心脏治疗新策略,将源自人类诱导多能干细胞(HiPSC)的心脏球体(心脏细胞的三维簇),注射到患有心肌梗塞的猴子体内,并观察到良好效果。相关研究26日发表在《循环》杂志上。
“再生”一颗完好心脏,人类诱导多能干细胞(HiPSC)培育的心肌细胞修复猴子心脏功能
iPSC与心力衰竭
心力衰竭(HF)是一种由于心脏泵血功能失常引起的疾病,导致心脏不能满足全身的基础代谢需要。常诱因包括心肌梗死、心肌病、心肌炎等。高发人群包括70岁以上的老年人,其发病率超过10%,5年死亡率可达50%。心力衰竭可以按照病变部位分为左心衰竭、右心衰竭和全心衰竭。
2024年3月13日,大阪大学、京都大学、千叶大学的研究人员在《Stem Cell Research & Therapy》 发表了题为 “人诱导多能干细胞来源的心肌细胞贴片的疗效和安全性的临床前评估”的研究。在这项研究中,研究人员确定了临床级 hiPSC-CM 贴片是否可以作为功能性心肌组织。并进行了一项临床前研究以确保其安全性,并对临床应用中的hiPSC-CM贴片进行了概念验证分析。
结果:hiPSC-CMs表达心肌细胞特异性基因和蛋白质,电生理学分析显示hiPSC-CMs表现出与人原代心肌细胞相似的特性。
诱导多能干细胞(iPSC)来源的心肌细胞治疗心力衰竭(HF)的疗效和安全性
iPSC与神经系统损伤
在一项新的研究中,来自美国西北大学等研究机构的研究人员利用人类诱导性多能干细胞(induced pluripotent stem cell, iPSC)构建出首批高度成熟的神经元,这一壮举为针对神经退行性疾病和创伤性损伤的医学研究和潜在移植疗法提供了新的机会。相关研究结果发表在Cell Stem Cell期刊上,论文标题为“Artificial extracellular matrix scaffolds of mobile molecules enhance maturation of human stem cell-derived neurons”。
虽然以前的科学家们已将干细胞分化为神经元,但这些神经元在功能上是不成熟的---类似于胚胎或出生后早期的神经元。
将iPSC衍生的神经元移植到患者体内,可以取代受损或丧失的神经元,恢复失去的认知或感觉。而且,由于最初的细胞来自患者,iPSC衍生的神经元将与患者的基因相匹配,消除了免疫排斥的可能性。
《Cell》:利用诱导性多能干细胞iPSC产生高度成熟的神经元,为脊髓损伤/神经退行性疾病提供了新的机会!


